AĞRI VE AĞRI MEKANİZMALARINA GÜNCEL BAKIŞ
Prof. Dr. Ersin Erdoğan
Uluslararası Ağrı Araştırmaları Derneği (International Association for the Study of Pain = IASP) ağrıyı, vücudun herhangi bir yerinden başlayan, organik bir nedene bağlı olan veya olmayan, kişinin geçmişteki deneyimleri ile ilgili, sensoryal, emosyonel, hoş olmayan bir duygu olarak tarif etmiştir. Ağrının, doku hasarının bilinçsiz olarak farkına varılması şeklinde de tanımlanabileceği bildirilmiştir. Merskey, ağrıyı; gerçekte mevcut olan veya potansiyel doku hasarı ile birlikte bulunan, hoş olmayan duyusal ve emosyonel tecrübe olarak tanımlamıştır. Esener’e göre ağrı; herhangi bir dokuda hasar oluştuğunda ortaya çıkan, kompleks ve nahoş bir algılama olup, hastayı doktora getiren en önemli nedendir. Ertekin ise ağrıyı, bedenin bir köşesinden köken alan, hoş olamayan, kişiyi panik ve kaçış davranışına yönelten algılamadır diye tariflemiştir.
Ağrı çeşitli şekillerde sınıflanabilir:
IASP Taksonomi Alt Komitesi; ağrıyı beş eksenli taksonomi şeklinde, eksen bazında tanımlamıştır. Bu tanımlamaya göre; 1. eksen ağrının yer aldığı vücut bölgesi ile ilgilidir. İkinci eksen ağrının etkilediği sistemleri, 3. eksen oluşum süresini ele alır. Dördüncü eksen, hastanın ifadesine göre ağrının şiddeti ve başladığından bu yana geçen süreyi, 5. eksen ise ağrının etiyolojisini belirtir.
Raj, ağrıyı 4 ana başlık altında tanımlamıştır:
1. Nörofizyolojik mekanizma: a. Nosiseptif, b. Somatik, c. Visseral, d. Nöropatik (nonnosiseptif), e. Psikojenik
2. Süreye bağlı: a. Akut, b. Kronik
3. Etiyolojik: a. Kanser ağrısı, b. Postherpetik nevralji, c. Orak hücre anemisine bağlı ağrı, d. Artrit ağrısı
4. Bölgesel ağrı: a. Baş ağrısı, b. Yüz ağrısı, c. Bel ağrısı, d. Pelvik ağr
Ağrı tanımında sık kullanılan bir başka sınıflandırmada, başlama süresi, mekanizması ve kaynaklandığı bölge dikkate alınmaktadı
I. Ağrının başlama süresine göre sınıflama
1. Akut ağrı: Daima nosiseptif nitelikte olup, vücuda zarar veren bir olayın varlığını gösterir. Neden olan lezyon ile ağrı arasında yer, şiddet ve zaman bakımından yakın ilişki vardır. Nedenleri arasında, travma, enfeksiyon, doku hipoksisi ve enflamasyon sayılabilir. Postoperatif akut ağrı en iyi örnektir. Akut ağrı, üzerinden 3-6 ay süre geçtiğinde kronik ağrı özellikleri gösterir.
2. Kronik ağrı: Çoğu kez nosiseptif nitelikte olup uyarıcı işlevi geçtikten sonra, kişinin hayat kalitesini değiştiren, kişileri anormal davranışlara yönelten, psikolojik etkenlerin rol oynadığı kompleks bir tablodur. Akut ağrıdaki kadar otonomik cevaplar yoktur. Sempatik tonus artışı, nöroendokrin fonksiyonda artış belirgindir.
II. Mekanizmalarına göre ağrı sınıflaması
1. Nosiseptif ağrı: Daha sonra etraflıca incelenecektir.
2. Nöropatik ağrı: Nonnosiseptif ağrı için en yaygın kabul gören terimdir. Nosiseptif ağrıdan en belirgin farkı, sürekli bir nosiseptif uyarının bulunmamasıdır. Santral veya periferik yaralanmaya sekonder yapısal veya fonksiyonel sinir sistemi adaptasyonlarının neden olduğu ağrıdır. Önceleri psikojenik olarak değerlendiren ağrı, son zamanlarda daha iyi tanımlanmış ve santral orijinli nöropatik ağrı olduğu anlaşılmıştır. IASP santral ağrıyı, “santral sinir sisteminde fonksiyon bozukluğu veya primer lezyonun başlattığı veya neden olduğu ağrı” olarak tanımlanmıştır. Spinal kord yaralanması, multipl sklerozis, epilepsi ve inme gibi yapısal değişikliklere bağlı ağrılar örnektir. Nöropatik ve nörojenik ağrı karıştırılmamalıdır. Nörojenik ağrı, herhangi bir nöropatik oluşturma şartı aranmaksızın periferal sinir yaralanması ile ortaya çıkan ağrıdır. Nöropatik ağrı metabolik hastalıklar sonucu ortaya çıkan ağrıyı da tanımlamak için kullanılır. Ağrı spontan olarak ortaya çıkabilir. Ağrı eşiği düştüğü için normalde ağrısız olan uyarı ağrı yapabilir (allodini). Uyarıya yanıt hem sürekli hem de amplitüd bakımından abartılı olabilir (hiperaljezi). Nöropatik ağrı opioid ilaçlara ve nörolitik işlemlere nosiseptif ağrıdan daha az yanıt verir. Sinir kompresyonuna veya inflamasyonuna bağlı mononöropati, şimşek çakar gibi nevraljiler, diyabetik polinöropatiler ve deafferantasyon ağrısı nöropatik ağrı çeşitleridir.
3. Deafferantasyon ağrısı: Periferik ve santral sinir sistemi yaralanmaları sonucunda somatosensoryal uyaran iletiminin merkezi sinir sistemine gidişinin kesilmesi ile ortaya çıkar. Talamik ağrılar, fantom ağrıları örnektir.
4. Reaktif ağrı: Motor ya da sempatik afferentlerin refleks aktivasyonuyla nosiseptörlerin uyarılması sonucu oluşan miyofasiyal ağrı örnektir.
5. Psikosomatik ağrı (Psikojenik ağrı): Anksiyete ve depresyon gibi psikolojik sorunlarda doku hasarı varmış gibi algılama olmaktadır.
III. Kaynaklandığı bölgeye göre ağrı sınıflaması
1. Somatik ağrı: Somatik sinirlerden kaynaklanan, ani başlayan, keskin, iyi lokalize edilen ağrıdır.
2. Viseral ağrı: İç organlardan kalkan ağrılı uyaranlar, otonom sisteme ait afferent yollarla taşınırlar. Kolon, rektum ve mesaneden kalkan uyarılar sakral parasempatik sinirlerle m. spinalise taşınır. Farenks, trakea ve özefagusun üst kısmından kalkan uyarılar, glossofaringeus ve vagus sinirleri ile, geri kalan bütün organlardan kalkan uyarılar sempatik sinirlerle m. spinalise taşınırlar. Kimyasal irritanlar, organların ani gerilmesi, aşırı kasılmalar ve kan akımının azalması nedenler arasında sayılabilir. Viseral ağrı yaygın, lokalizasyonu güç, yansıyan tipte olabilir. Kan basıncı ve nabız sayısında değişme, kas rijiditesi ve hiperestezi ile birliktedir.
3. Sempatik ağrı: Sempatik sinir sisteminin aktivasyonu ile ortaya çıkan damarsal kökenli ağrılar, CRPS (kompleks rejyonal ağrı sendromu) ve kozaljiler örnektir.
4. Periferal ağrı: Kaslar, tendonlar veya bizzat periferik sinirlerin kendinden köken alabilir.
Bir başka sınıflandırma da normal fonksiyon gösteren sinirler ile patoloji sonrası fonksiyonları değişen sinirler arasındaki farka göredir;
Derin ağrı: Eklem, tendon, kas ve fasyadan kalkan uyarılar, cilttekine benzer olarak ince liflerle taşınır ve aynı yollarla iletilir. Genellikle künt ve zonklayıcı tiptedir. İyi lokalize edilemez ve yayılma eğilimindedir. Derin ağrı, liflerin sonlarının kimyasal maddelerle uyarılması, kas liflerinin gerilmesi gibi mekanik etkiler sonrası görülür.
Yüzeyel ağrı: Deri ve mukozadan köken alan ağrıdır.
Yansıyan ağrı: Bazı organ ve derin dokulardan kaynaklanan ağrılar, uyarı yerinden farklı bir yerde duyulabilir. Kardiyak ağrının sol kola, diyagrafmatik ağrının sol omuza yansıması gibi. Birçok dermal ve viseral afferent lifin, ağrı yolu üzerinde aynı ikinci nöron üzerine konverjansı ile açıklanmaktadır.
Tetik noktaları (Trigger alanlar, Miyaljezik noktalar): Cilt, kas ve bağ dokusunda küçük, yuvarlak, hipersensitif alanlardır. Yansıyan ağrı ile yakından ilgilidir. En sık olarak miyofasiyal yapılarda görülürler. Akut yaralanmalarda yaralanma bölgesi dışında da oluşmaktadır. Bu noktalar basınç, iğneleme, hareket, gerilme, aşırı sıcak veya soğukla aktive olur. Kas-iskelet sistemindeki birçok tetik noktasının yerleşimi, klasik akupunktur noktalarına uymaktadır. Tedavide, noktanın belirlenmesi ve lokal anestezik ile bloke edilmesi etkili olmaktadır.
Ağrı tanımlanmasında kullanılan tanımlar:
Allodini: Ağrı olmaması gereken d okunmayı, ağrı olarak algılama
Analjezi: Ağrı duyusunun olmaması
Anestezi Dolorosa: Duyu kaybı olan bölgede ağrı
Dizestezi: Uyarı ile veya uyarısız olarak nahoş ve anormal duyu
Hipoaljezi: Ağrılı uyaranlara azalmış reaksiyon
Hiperestezi: Ağrılı uyaranlara artmış reaksiyon, sensoryal liflerin aşırı duyarlılığı
Hiperpati: Hiperestezi, allodini, hiperaljezi + artmış reaksiyon + uyarı kesildikten sonra da duyunun devamı
Hipoestezi: Azalmış cilt duyarlılığı (hafif dokunma, bası ve ısıya karşı)
Kozalji: Periferik sinirlerdeki tahribat sonucu gelişen, yanıcı karakterdeki ağrıdır. İlgili bölgeye çok hafif dokunma bile ağrı oluşturabilir.
Nöralji: Bir spinal veya kraniyal sinirin dağılım alanında görülen, tekrarlayıcı, şiddetli ve genellikle ilgili cildin uyarılması ile başlayan bir ağrıdır.
Parestezi: Belirli bir bölgede, herhangi bir uyarıcı olmadan, spontan olarak iğnelenme, karıncalanma veya uyuşma hissedilmesidir. Dorsal kök, periferik sinir veya santral sinir sistemi irritasyonuna bağlı olabilir.
Radikülopati: Bir veya birden fazla sinir kökünün anormal fonksiyonu
Hiperaljezi: Zararlı uyarılara abartılı reaksiyondur.
Fizyolojik ağrı: Doku hasarı yapabilecek şiddete yakın, ancak belirgin bir enflamasyon ya da sinir hasarı uyarılarının neden olduğu duyu şeklidir. Mekanik, kimyasal veya termal uyarıların etkileri, bası, yanma, sıcak ve soğuk şeklinde algılandıkları derecenin biraz üstüne çıktıklarında artık ağrı olarak algılanmaktadır.
Patolojik ağrı: Doku enflamasyonu ve sinir hasarı sonunda otaya çıkmaktadır.
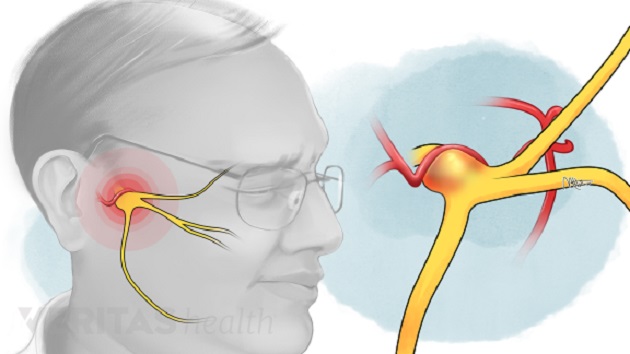
Nosisepsiyon
Ağrı, kapsülsüz sınır sonlarının aktivasyonu sonucu doku yaralanmasıyla oluşur. Bedenin bir bölgesindeki doku yaralanmasında uyarının özelleşmiş sinir uçları ile (nosiseptör) alınıp, santral sinir sistemine götürülmesi, belirli bölge ve nöral yapılarda entegre edilmesi, bu zararlı tehdidin (noxious uyarı) algılanması, buna karşı fizyolojik, biyoşimik ve psikolojik önlemlerin harekete geçirilmesidir. Nosisepsiyon, doku hasarı ile ağrının algılanması arasında oluşan karmaşık elektrokimyasal olaylar serisinin bütünüdür. Ağrı, nosisepsiyon içinde bir algılama olayıdır. Latince’de Noci, zarar veya zedelenme anlamındadır. Travmatik veya noxious stimulasyona nöral cevaptır. Tüm nosiseptör uyarılar ağrı oluşturur, fakat tüm ağrılar nosisepsiyondan kaynaklanmaz. Aslında nosiseptörler periferik terminalleri ağrılı uyaranlara hassas primer afferent ve tüm deri, deri altı dokularında bulunan çıplak ve serbest sinir uçlarıdır. Miyelinsiz C lifleri ile miyelinli A-delta (d) liflerinin distal uzantılarından oluşmuşlardır ve 100-400 mm uzunluğundaki aksonal sonlanmalar, küçük kan damarları ve mast hücreleri kenarında sonlanırlar. A-delta liflerinin uçları genellikle uyarıldıkları tipe göre termal veya mekanik nosiseptörler adını alır ve 30 m/sn hızda ileti oluştururlar. Dolayısıyla bu nosiseptörlerin aktivasyonu keskin, iğneleyici ve iyi lokalize edilebilen bir ağrı oluşturur. C liflerinin uçları, polimodal nosiseptör adını alır ve şiddetli mekanik, kimyasal, aşırı sıcak ve soğuk uyaranlarla aktive olurlar. C lifleri, enflamasyonda olduğu gibi gecikmiş, yanıcı ve inatçı karakterdeki ağrıdan sorumludurlar. İmpulsları 0.5-2 m/sn gibi çok yavaş olarak ilerletirler. Dolayısıyla daha donuk, daha yaygın ağrı ve hiperestezi oluştururlar.
Normal fizyolojik koşullarda ağrı ve nosisepsiyon, hoş olmayan bir algılama olarak görülse de amacı organizmayı zararlı bir saldırıdan korumak ve ilgili savunma mekanizmalarını ortaya çıkarmaktadır.
Nosiseptif prosesin periferal komponentleri
Periferik çıplak sinir uçlarının uyarılması, nörotransmitter salınımına yol açar. Substant P (SP) ve diğer taşikininlerin lokal salınımı, vazodilatasyon ve plazma ekstravazasyonuna yeter miktarda iseler ödem oluşur. Vazodilatasyonu takiben histamin ve bradikinin, kan hücrelerinden lokal olarak salınır ve ikisi de nosiseptörleri sonraki uyarılar için sensitize edebilir (hiperaljezi). Doku yaralanması ve SP mast hücrelerini aktive eder.
Primer afferent lif transmitterleri: Küçük liflerin çoğu eksitatör amino asitleri (EAA), aspartat, glutamat ve nöropeptidleri (substant P, kalsitonin, gen-related peptid, kolesistokinin, galanin, somastatin, vb.) içerir. Bu maddeler sıklıkla aynı afferent terminalde toplanmışlardır. Eksitatör amino asitler hem geniş hem de küçük çaplı primer afferent liflerde bulunurlar ve eklem inflamasyonunda kronik veya akut nosiseptif uyarı sonucu A-beta (b) liflerince aktive edilen düşük akımlı elektrik aktivitesi sonucu salındıkları gösterilmiştir. Eksitatör amino asit reseptörlerinin, N-metil-D-aspartat (NMDA) ve non-NMDA (AMPA/kainate ve metabotropik) reseptörler gibi postsinaptik ve spinal dorsal boynuz hücrelerinde bulunan birçok alt tipi vardır. Çeşitli çalışmalarda hem NMDA hem de non-NMDA reseptör agonistlerinin intratekal olarak uygulanmasında nosifensif davranış oluştuğu bildirilmiştir.
Sinirle inerve edilen periferik hedefler, afferent liflerin çapından çok peptid içeriği ile ilgilidir. Aslında sinirler yeni periferal dokuları tekrardan uyardıklarında peptid içerikleri değişmiş gibi gözükür (afferent axonun fenotip transmitteri değişir). Nosiseptif dorsal boynuz nöronlarının büyük kısmı, substance P içeren snapsların önemli kısmıyla bağlantılıdır.
Periferde salınan ve noxious uyarı özelliği taşıyan nörotransmitterler;
Bradikinin: Zararlı mekanik uyarı ile hücre zarı permeabilitesi bütünlüğü bozulur ve lokal hücre yıkımı sonrası hücre dışına öncül maddeler çıkar. Bradikinin, nosiseptörü direkt olarak aktive eder ve çevre damarlarında vazodilatasyon yaratır. Ayrıca hücre zarları üzerine etki yaparak prostoglandin oluşumuna da katkıda bulunur.
Serotonin: Trombositlerden salınır. Direkt olarak nosiseptörü aktive eder. Hücre zarlarına etki ederek prostaglandinlerin salınmasına yol açar.
Direkt doku travması ile serotonin ve bradikinin hücre membranlarında fosfolipidler üzerine etki yapması ile prostoglandinler ve lökotrienler serbest hale gelir. Burada anahtar durumundaki öncü madde araşidonik asittir. Siklooksijenaz enzimi ile siklik endoperoksitler ve buradan da prostaglandinler oluşur. Prostaglandinler hem nosiseptif duyarlılığı artırırlar hem de lokal dolaşımda vazodilatasyonu artırarak daha fazla algojenik madde birikmesine yol açarlar. Refleks mekanizma ile duyarlı hale gelen nosiseptör uçlardan nöropeptidler çevre dokuya salgılanır. Özellikle P maddesi, nörokinin A ve CGRP (calsitonin-gene related protein) gibi taşikininler bölgede ödem ve yangının başlamasına yol açarlar. P maddesi mast hücrelerinden histamin salınmasına neden olur.
AĞRININ ALGILANMASI
Periferde bulunan ağrıya hassas nosiseptörlerin aktivasyonu veya hasar görmüş dokudan salınan mediyatörler tarafından, medulla spinalise afferent transmisyon ve dorsal boynuz üzerinden yüksek merkezlere ileti aşamaları ile gerçekleşir.
Ağrı 4 aşamada algılanır;
1. Transdüksiyon: Sinirlerin sensoryal uçlarında, stimulusun elektriksel aktiviteye dönüştürüldüğü aşamadır.
2. Transmisyon: İmpulsların sensoryal sinir sistemi boyunca yayıldığı aşamadır.
a. Primer sensoryal afferent nöronların, elektriksel aktiviteyi spinal korda iletmesi
b. Uyaranın spinal kordda, assendan ileti sistemi ile beyin sapı ve talamusa iletilmesi
c. Talamokortikal projeksiyon
3. Modülasyon: Nosiseptif transmisyonun nöral etkenlerle modifiye olmasıdır.
4. Persepsiyon: Bireyin psikolojisi ile etkileşimi ve subjektif emosyonel deneyimleri sonucu gelişen, uyarının algılandığı son aşamadır.
Spinal veya belirli kraniyal sinirlerdeki lifleri veya A-delta liflerindeki elektriksel impulslar olarak spinal kök veya beyin köküne gider. Bir seri kompleks kimyasal etkileşimler ile sinaptik bileşkeyi geçtikten sonra sinyal nosiseptif spesifik yüksek SSS seviyelerine bir kez daha elektriksel olarak geçer. Ya da ağrıya daha az spesifik WDR nöronlarına gider.
Ağrının iletimi ve algılanması konusunda Ken Casey’in “nosisepsiyon dorsal boynuzda doğar, beyine ulaşıncaya kadar onu ağrı olarak isimlendiremeyiz.” ifadesini unutmamalıyız.
Ağrı iletimi ile ilgili nöronlar
A-delta ve C lifleri omuriliğe girince hemen ikiye ayrılırlar. Birkaç segment yukarı aşağıya deva ederek Lissauer traktusunun bir kesimini oluştururlar. Bunların akson kollateralleri de dorsal boynuz içine girer. Nosiseptif sinir uçlarının bu santral terminalleri dorsal boynuz gri cevherinin marjinal zonu (lamina-I) ile substantia gelatinosa (lamina-II)’da yer alan nöronlarla sinaps yaparlar. Bazı A-delta liflerinin uzantıları daha derinde bulunan lamina-V hücrelerine ulaşır.
Ağrılı uyaranları taşıyan periferik liflerin hücre cismi, yani ağrı yolunun 1. nöronu arka kök gangliyonlarında yer alır. Buradan kalkan lifler spinal korda girer ve substantia gelatinosa’da (SG) arka boynuz hücreleri ile sinaps yapar. (2. nöron). Yani ağrı iletiminde ikinci durak spinal korddur. Substantia gelatinosa’da enkefalinerjik ara nöronlar bulunmaktadır. Ağrı yolunun 3. nöronu talamustadır.
Arka boynuzdaki nöronlar 3 çeşitt
a. Projeksiyon nöronları (santral geçiş hücreleri); oluşan sinyal ve impulsları anterolateral afferent sistemden üst merkezlere iletirler. Projeksiyon nöronlarını başlıca iki grupta incelemek olasıdır. Lamina I’de yoğun olarak bulunan ve sadece A-delta ve C-lifleri ile birlikte uyarılan projeksiyon nöronları “nosiseptif spesifik = NS” dir. Lamina I ve V’de bulunan ikinci grup projeksiyon nöronları hem nosiseptörlerden hem de düşük eşli mekanoreseptörlerden lif uyarımı alan “wide dynamic range = WDR” nöronlarıdır.
b. Eksitatuar nöronlar; ağrılı uyaranları projeksiyon nöronlarına ileterek ekşite olmalarını sağlarlar.
c. İnhibitör nöronlar; geniş çaplı liflerle eksite olduklarında projeksiyon nöronlarında inhibisyona neden olurlar. Genellikle C ve A-delta liflerinden gelen sinyallerle aktive olan bu ara nöronlar, ağrılı sinyalleri projeksiyon nöronuna geçirirler.
Ağrılı uyarıları üst merkezlere geçirmede, dorsal boynuzunda başlıca iki tıp nörotransmitter rol almaktadır. Bunlar glutamat ve nöropeptidlerdir.
Glutamat; A-delta terminal uçlarından ve motor nöronlara sinaps yapan afferentlerden salgılanan eksitatör bir aminoasittir. Dorsal boynuz projeksiyon hücrelerinde çok kısa süreli veya çok uzun süreli depolarizasyon yaratabilir. Çok kısa etkisini, “ligand-gated” Na/K iyonlarını açması ile, uzun süreli depolarizasyon etkisini N-Metil, D-Aspartat (NMDA) kullanarak gerçekleştirir.
Nöropeptidler; Özellikle C lifleri eksitasyonu ile oluşurlar ve projeksiyon hücrelerinde çok yavaş ve çok uzun süreli depolarizasyona yol açarlar. Bu nöropeptidler arasında; P maddesi, nörokinin-A, kolesistokinin ve kalsitonin-gen related peptid (CGRP) sayılabilir. C lifleri uçlarından birden fazla nöropeptidleri salgılanabilir.
Kapı kontrol teorisi
Wall ve Melzack tarafından 1965’te ortaya atılmıştır. Periferden gelen yoğun afferent nosiseptif impulslarla eksitan ara nöronlar aktive olmakta ve bu inhibitör ara nöronu inhibe ederek ve de projeksiyon nöronunu ekşite ederek ağrılı impulsların santral sinir sistemine geçmesine yol açmaktadır. Ancak aynı zamanda A ve B grubu geniş miyelinli liflerin aktivasyonu ile inhibitör ara nöronları aktive ederek projeksiyon ara nöronlarını inhibe etmekte ve ağrılı sinyallerin geçişini durdurmaktadır. Bu mekanizma TENS (transkutanöz elektriksel sinir uyarımı) ve spinal kord stimulasyonu gibi geniş çaplı lifleri uyartan sağaltım yöntemine temel olmuştur.
Dorsal boynuz geçişi: Dorsal boynuzda salınan substant P’ye ilaveten C lifleri diğer uyarıcı transmitterleri (glutamat, aspartat, kalsitonin gen related peptid (CGRP) ve nitrik oksit salar. Nitrik oksitin gerçek rolü tam olarak tanımlanamamıştır fakat diğer pek çok yerlere ilaveten sinapsın diğer tarafında da üretildiği bilinmektedir.
Nitrik oksit (NO) ağrı ilişkisi: NMDA reseptörlerinin aktivasyonu nitrik oksit sentetazı (NOS) aktive eder ve NO oluşur. Prostoglandinler ve NO medulla spinaliste uyarıcı aminlerin serbestleşmesini sağlar. Nitrik oksitin nosiseptif olaylardaki rolü tam olarak açığa çıkmamıştır ve akut nosisepsiyonda çok önemli değildir. Ancak kronik ağrı durumlarında NO indüksiyonu önem taşıyabilir ve hücre ölümünde önemli rol oynayabilir. Nitrik oksitin ağrı üzerinde bir pozitif feedback mekanizması oluşturduğu düşünülmektedir. Nitrik oksitin blokajı nöropatik hayvan modellerinde ağrının azalmasına yol açmaktadır. Enflamasyonda olduğu gibi NO’nun ağrıda da rol aldığı ileri sürülmektedir. Tedesco ve ark. poliartritli rat modelinde NOS inhibitörlerinin ağrı ve enflamasyon üzerine olan etkilerini araştırdıkları çalışmalarında; NO’nun mekanik değil ama termal duyu yollarında etkili olduğunu ve uyarılmış NOS aktivasyonunun selektif inhibisyonunun, oluşturulmuş enflamasyonu arttırdığını bildirmişlerdir. Dray, pek çok mediyatör gibi NO’nun da tümöre bağlı nosisepsiyonda rolü olduğunu vurgulamıştır. Nitrik oksit, NOS’ın aktivasyonuyla L-argininden oluşur. Bu mediyatörün düşük konsantrasyonları hemostatik rol oynarken, büyük konsantrasyonları patolojik olur ve yıkıcı etki taşır. Nitrik oksit sentetazının inhibitörleri nöronal, endotelyal isoformlar için farklı selektivite taşır, ki bu da onun faydalı veya zararlı özelliklerini gösterir. Bu sahadaki son gelişmeler ışığında NO, enflamatuar hastalıklar, ağrı, nörolojik hastalıklar, şok, ateroskleroz ve kanser tedavisinde alternatif yöntemler sunabilir.
Temporal sumasyon: Eğer bir uyarı dorsal boynuzdaki sinapsa 3 dakikadan daha sık aralıklarla gelirse, post-sinaptik elektrik deşarj daha fazla uzar. Bu da ağrının şiddetinde artışla sonuçlanır. Temporal sumasyon, wind-up olarak isimlendirilir.
Dorsal boynuz patofizyolojisi: Özellikle ağrı ısrarlı olduğunda, nöropatik değişiklikler oluşabilir. Bunların doğası, oluştuğu koşullar, aynı zamanda nasıl önleneceği veya geri çevrileceği sonraki araştırmaların odağı olmalıdır.
Primer afferent lifler: Ağrı duyarlılığı; uyarının modeline değil daha çok afferent liflerin uyarılmasına bağlı gibi gözükmektedir. A-dnosiseptörlerinin uyarılması kısa süreli iğnelenme (karıncalanma), C liflerinin aktivasyonu ise kötü lokalize yanma duyusunu oluşturur. Ağrıyla ilgili çalışmalarda, sadece nosiseptörlerle ilgili liflerin uyarılması anlamlı bulunmuştur. Diğer liflerin aynı ve yüksek frekanstaki uyarısı, hiçbir zaman ağrı duyusuyla sonuçlanmaz. Doku yaralanması olmadığında, afferent nosiseptif liflerin aktivitesi ya çok azdır ya da hiç görülmez..
Nosiseptif Dorsal Boynuz Hücre Tipleri:
a. Nosiseptif-spesifik nöronlar: Lamina I ile daha küçük ve daha derindeki Lamina V birçok nosiseptif spesifik hücreler taşır. Bunlar yüksek eşikli, potansiyel olarak dokuya zarar verici stimulusa selektif yanıt verirler. Bazıları türe özel (termal veya mekanik uyarana yanıcı tarzda yanıt) olmasına rağmen bazıları kimyasal uyarılara yüksek oranda yanıt yanında, diğerlerine de yanıt verebilir. Alıcı bölgeler genellikle küçüktür ve deri ile kaslardan oluşur. Uyarının özelliğinden bağımsız olarak nosiseptör spesifik nöronlardaki aktivite, nosiseptörlerin uyarılmasıyla oluşan belirli mesajı sağlar.
Lamina I’deki diğer önemli hücre tipleri;
1. Termoreseptif soğuk hücreler; zararsız soğuk ve ısıtma ile aktive ve inhibe olurlar.
2. Isı, sıkışma, soğuk hücreleri, geleneksel nosiseptif spesifik hücrelerine benzerler fakat zarar verici soğuk tarafından uyarılırlar.
b. WDRN (Geniş-Dinamik-Alan Nöronları): Lamina I’de bir miktar bulunmasına rağmen, çoğunluğu derin Lamina V ve çevresinde, dorsal boynun boynunda bulunur. Zararsız ve nosiseptif uyarıya yanıt vermesi nedeniyle böyle isimlendirilmiştir. Zararlı uyarıya yanıtları maksimaldir. Bir başka deyişle, uyarıyı yoğunluğunun frekansına göre değerlendirirler. Lamina X, WDR nöronların büyük bölümünü oluşturur ve yüksek oranda viseral uyarıları içerir.
c. Diğer hücreler: Substantia gelatinosa (Lamina II) deki hücrelerin yanıt özellikleri farklıdır. Yüksek oranda süren aktiviteleri ve küçük alıcı bölgeleri vardır. Yüksek yoğunluklu uyarı ile inhibe olan ve nosiseptif uyarının rostral yayılımından sorumlu hücreler vardır. Derinin aynı sahasına hafif dokunuş, bu hücreleri aktive eder.
Dorsal Boynuz Nöronlarının Yanıt Özellikleri
Önceleri sadece yüksek eşikli küçük afferentlerden uyarı alan nöron topluluğu olarak bilinmelerine rağmen daha büyük kısmı afferent konverjans özelliğine sahiptirler.
Lif konverjansı (yakınlaşması): WDR nöronları rutin olarak geniş miyelinli (Ab, Ad) ve miyelinsiz C liflerinden uyarı alırlar. Tek hücreye konverjans, hücrenin büyük uyarı yoğunluklarına düzeltilmiş yanıt vermesine olanak sağlar.
Modalite konverjansı: Bir WDR hücresi, termal ve mekanik uyarana cevap verebilir. Bu özellik onun uyarıyı mekanoreseptörler (Ab ve Ad) (Ad ve C) gibi masum ve zararlı termoreseptörlerden (A ve C) alabileceğinden kaynaklanır. Bu özellik, WDR hücresinin, afferent trafiği entegre etme ve uyarının yoğunluğunu modalitesinden bağımsız olarak düzenlemesine olanak sağlar.
Organ Konverjansı: Wide dynamic range hücresi viseral organlar yanında deri ve kastan da uyarı alabilir. Bu özellik değişik organ veya bölgelerin birbirleriyle olan planlanmış somatotopikal konverjansını organize eder. Böylece sol torasik spinal kord dorsal boynuz nöronlarının bazılarık kol ve omuzdan input alırlar. Bu hücreler aynı zamanda koroner damar ve kaslardan kardiyak afferent input alırlar. Bu konverjans koroner iskeminin sol kolda ağrılı olarak algılanması ile ilgilidir (viseral yansıyan ağrı).
Nosiseptif geçişin spinal modülasy
Afferent input ve spinal output arasında duyusal algılamaya yol açan ilişki vardır. Input-output ilişkisinin koordinasyonu, birçok algılama tipinin fonksiyonu olarak görülür. Bazısı hiperaljezi veya allodini gibi oranda artış, bazısı da çıktıda azalma ve dolayısıyla analjezi oluştur.
Spinal Yardım: WDR nöronlarının bir özelliği “wind-up” fenomenidir. WDR hücrelerinin uyarılması C liflerini aktive ediyorsa ve uyarı >0.33 Hz ise, hücresel yanıt süre ve büyüklük bakımından artar. “Wind-up”, hücrenin uzun sürdürülmüş parsiyel depolarizasyonu ve gelişmesiyle değişir, bu da membranın afferent inputa artan şekilde duyarlı olmasına yardımcı olur.
“WIND-UP”ın özellikleri: Wind-up santral duyarlılığın spesifik subtipi olarak görülür. Wide dynamic range ve NS dorsal boynuz hücrelerinde girdi-çıktı oranlarında jeneralize artış gözlenir. Santral duyarlılık, artmış reseptif bölgeyle sonuçlanır. Dermatomalalanlardan, önceleri nöronları aktive etmeyen afferent inputlar belirgin yanıt oluşturmaya başlar. Ayrıca düşük eşikli taktil uyarılar, artan şekilde efektif olmaya başlar (allodini).
“Wind-up”ın farmakolojisi: Bu tip yavaş, süregiden uyarının nörokininlerin (özellikle substant P = SP, EAA, NMDA reseptörlerinden) tekrar salınımından oluştuğu düşünülmektedir. N-Metil D-Aspartat antagonistleri ve nörokinin reseptör 1 (NK), spesifik antagonistleri SP için majör bağlanma noktasıdır. Psikofiziksel çalışmalarda, çoğalmış ikincil ağrı (hiçbir zaman birincil ağrı değil) veya ikincil ağrının tabanı NMDA antagonistlare ile tedavi edilememiştir. Bu morfinin oluşturduğu redüksiyona ters düşer. Prostoglandin ve nitrik oksit salan moleküllerin intratekal uygulanması ağrıya (allodini ve hiperaljeziye) yol açar. Aydın ve Erenmemişoğlu merkezi etkili benzodiazepinlerin de sistemik (intraperitoneal) kullanımlarında hiperaljezi oluştuğunu saptamışlardır. Siklooksigenaz inhibitörler ve nitrik oksit sentez inhibitörlerinin uygulanması ise hiperaljezi ve allodiniyi azaltır. Siklooksigenaz izoenzimini bloke eden kortikosteroidlerin antihiperaljezik olduğu düşünülmektedir.
NOSİSEPTİF ÇIKICI SİSTEMLER
Spinotalamik ve spinoretiküler yol uzun yıllardır çok iyi bilinmektedir. Diğer yolaklar yeni tanımlanmıştır veya uzun yıllar önce tanımlanmalarına rağmen, herkesçe yeni kabullenmiştir (Şekil 1). Bu yolakları şöyle tanımlayabiliriz.
1. Spino-talamik yol: Nosiseptif uyarı geldiğinde Lamina I, V ve VII. nöronlarından köken alır, orta hattı geçer, anterolateral çıkıcı sistem içinde ilerler ve spinal kordun karşı tarafında, talamusun VPL (ventral posterolateral) çekirdeğinde (3. nöronda) sonlanır. Bu nükleus vücudun özel bölgeleri için bölümlere ayrılmıştır. Her bölge kendi primer duyusal korteksinin bölümüne projekte olur. Talamusdan çıkan uzantılar da kortekse giderek postsentral gyrusda sonlanır. Bu yol ağrının yer, şiddet ve zaman gibi özellikleri ile birlikte algılanmasını sağlar (aroual). Bu tanımlayıcı yolak, ağrının yeri hakkındaki bilgiyi bilinç düzeyine ulaştırır.
2. Spino-retiküler yol: Anterolateral çıkıcı sistem içinde ilerler ve çapraz yapmış dorsal boynuz aksonlarından oluşur. Bulbus ve ponstaki retikülerçekirdek gruplarına uzanır veya kollateraller verir. Spinal kordun iki tarafındaki sağ ve sol talamus intralaminar çekirdeklerine çıkar. Daha sonra nöronal bilgi singulat gyrusun ön parçası (emosyon), amigdal (hafıza ve emosyon), hipotalamus (emosyon ve emosyona vasküler yanıt) gibi birçok beyin bölgesine ulaşır. Acı yolağı olarak isimlendirilir. Korteksi ve subkortikal yapıları (limbik sistem ve diensefalon) genel bir uyanıklık içinde tutmak ve zararlı uyarana karşı genel bir alarm hali yaratmakla görevlidir.
3. Spino-mezensefalik yol: Dorsal boynuz Lamina I ve V’teki nosiseptif projeksiyon nöronları anterolateral sistem içinde yer alır ve spino-retiküler yol açok yakın olarak mezensefalik periaquaduktal gri cevhere dek yükselir. Bu beyin kökündeki parabrakial nükleusa giden yolakla aynı veya ilgili olabilir. Ön beyindeki parabrakial çekirdek, amigdala, hipotalamus ve diğer limbik sistem yapılarına projekte olur. Bu yolun periaquaduktaya bağlantı yapması nosisepsiyonda çok önemlidir. Çünkü burada analjezik etki sağlayan enkefalinerjik nöronlar vardır. Periaquaduktal gri cevher antinosiseptif mekanizmaların tetiklendiği en önemli bölgelerden biridir.
4. Dorsal kolon yolu: Damarsal (visseral) nosisepsiyonu ve aynı zamanda somatik dokunma ve pozisyon duyusunu talamusa taşıdığı sanılmaktadır.
5. Spino-hipotalamik yol: Retiküler formasyonda sinaps yapmayan, yeni tanımlanmış bir yoldur. Deri, dudak, genital organlar, gastrointestinaltraktus, intrakranial kan damarı, dil ve korneadan emosyonel önem taşıyan bilgiyi direkt olarak hipotalamusa taşır.
Santral Duyarlılık: Santral duyarlılık kronik ağrının karakteristiğidir. Uzun, devamlı uyarı ile fizyolojik değişiklikler olur. Genlerin ifadesindeki değişiklikler (ör: c-fos ve c-jun), dorsal boynuzdan kalkan sekonder nöronlar (spinotalamik ve spinoretiküler yollar) ile oluşur. Bu gen değişikliklerini, enzimlerin volüm ve tipini oluşan nöropeptidler etkiler. Bunlar postsinaptik hücrelerde uzun süreçli değişiklikleri indüklerler. Spinal kordun dorsal boynuzundaki yapısal reorganizasyon, ağrının anormal yayılımını açıklayabilir. Spinal kordun değişik seviyelerini içeren, uzak bölgelerden belirli bir alandan gelen lifler, bilinçlenme yapılacak nöronlara girer. Volüm iletimi, nöroaktif moleküllerin hedef bölgelerinden uzağa ekstrasinaptik yayılımıdır. Bu maddeler primer afferent nörotransmisyonun uzun süreli potensiyelizasyonuna ve hem nöronal uyarılabilirlik hem de gen ifadesinde kalıcı değişikliklere yol açar. Bu mekanizma yaralanma sahasının ilerisindeki ağrı algılanmasının yayılımını içerebilir. Birçok supraspinal ağrı düzenleyici nokta vardır. Bu noktalar ağrının miktarını artırabilir veya azaltabilir.
SEREBRAL KORTEKS VE AĞRI
Son 30 yıldır supraspinal ağrı mekanizmaları hakkında Melzac ve Casey’in teorileri kabul görmektedir. Bu yazarlar, ağrının duyusal diskriminitif(ayrımlaşma) ve affektif (hissi) motivasyonal komponentlerinin uzak nöral sistemlerle paralel olarak dağıldığını bildirmişlerdir. Özellikle lateralspinotalamik traktusun, talamusun lateral çekirdeğinin ve somatosensoryal korteksin, ağrının duyusal diskriminatif özellikleriyle ilgili olduğunu, buna ilaveten medial spinotalamik traktusun, talamusun medial çekirdeğinin ve limbik sistemle ilgili beyin bölgelerinin ağrının afektif-motivasyonel bölgeleri olduğunu belirtmişlerdir.
Değişik beyin sahalarının ağrılı uyaranlarla aktive olduğu düşünülmektedir. Bu bölgeler; talamus, putamen ve serebellum gibi subkortikalbölgeler ve suplementer motor korteks, anterior singulate korteks, anterior insular korteks gibi serebral kortikal bölgelerdir.
Bir yüzyıldan fazla zamandır yapılan çalışmalarda, harap edildiğinde ağrı deneyimi ortadan kalkan bir beyin bölgesi bulunamamıştır. Fokalbeyin harabiyeti, ağrının belli görünümlerini bozarken, ağrının diğer komponentleri saklı kalabilir. Beyinde lokalize ağrı merkezi yoktur. Ağrı, birçok beyin bölgesince işleme tabi tutulur.
Talamustan serebral kortekse nosisepsiyon bilgisini ileten multipl paralel yollar tanımlanmıştır. Ventroposterolateral (VPL), nükleus, ventroposterior inferior nükleus (VPI), posterior ventromedial nükleus (VMPo), posterior kompleks (Po), sentrolateral nükleus (CL), parafasiküler nükleus (Pf) ve medial dorsal nükleus (MD) nosiseptif nöronları içeren spinal kord bölgelerinden direkt input alır.
Tek taraflı ağrılı uyaran hakkındaki bilgi talamustan her iki serebral hemisfere direkt olarak transfer edilmektedir. Alışılagelmiş bilgilerin aksine, tek taraflı ağrılı uyarı hem kontralateral hem de ipsilateral talamusu aktive eder. Fonksiyonel görüntüleme çalışmalarında nöronların bilateralaktivasyonu gösterilmiştir.
Ağrı olayında serebral korteksin görevi tam olarak anlaşılamamıştır. Ağrıyla ilgili olayların kompleksliği ve beyin alanları arasındaki bağlantılara rağmen, nadiren özel beyin alanlarının birebir aktivasyonunun ağrı deneyimiyle ilişkisi vardır. Serebrumda ağrı ile ilgili bölümler; I. ve II. duyusal alanlar, frontal lob, 9 ve 12. alanlar, posterolateral bölgelerle beyinin çeşitli bölümlerini birbirine bağlayan assosiyasyon lifleridir. Ağrı olayındaki karmaşık ilişkilerin kısmen kortikal mekanizmalarla ortaya çıktığı ve özellikle frontal lobun bu üst düzeydeki işlevlerde rol aldığı düşünülmektedir.
Kortikal Ağrı Merkezi Var mı ?
Ne yazık ki ağrı düşünüldüğünde belirli bir merkez yoktur. Ağrı yaşam için o kadar önemlidir ki, yaklaşık tüm beyin onunla ilgilidir. Ağrının; bilinç, emosyon ve davranışla ilgisi vardır. Aşağıdaki kortikal sahaların ağrılı uyaran sırasında PET (positron emission tomography) scan ile incelenmesinde aktivite saptanmıştır. Brodmann’ın doku klasifikasyonu parantez içindeki sahalardır; duyusal ve motor korteks alanları (1-4), premotor korteks (ağrının algılanması için) (6), pariyetal korteksin diğer parçaları (7, 37-40), Frontal korteksin diğer parçaları (8-10, 43-47), cingulate korteks (24, 32), insula (14), oksipital korteks (19).
Ağrı; talamus, putamen, kaudate nükleus, hipotalamus, amigdala, periaquaduktal gri mater, hipokampus, kırmızı nükleus, pulvinar, serebellumun vermişi gibi subkortikal yapılara da geçer. Bunların hepsi Dennus Turk’un “ağrının merkezi temel olarak beyindedir” fikrini destekler. Ağrı kontrolünde bir başka merkez yoktur.
ANTİNOSİSEPTİF İNİCİ SİSTEMLER
Özellikle endojen opioid peptidlerin keşfi ile ağrılı uyaranlara karşı spinal ve supraspinal düzeyde enkefalinerjik ve monoaminerjik bir inhibisyon varlığı gösterilmiştir. Bunlar 3 gruba ayrılırlar (Şekil 1).
1. Mezensefalik periaquaduktal gri cevherde yer alan enkefalinerjik nöronlardır. Bunlar serebral korteks ve hipotalamus ile bağlantı içindedirler. Muhtemelen hipotalamus kökenli nöronlar endorfin taşımaktadır. Mezonsefalonda, Sylvius kanalının çevresine yerleşmiş nöronların oluşturduğu peiaquaduktal gri cevherden başlayan yol, busbustaki retiküler formasyona giderek nükleus rafe magnus ve nükleuretikülaris gigantosellularisteki serotoninerjik nöronlarla sinaps yaparlar. Böylece diensefalik endorfin ve mezonsefalik enkefalin nöronları bulbustaki serotonin nöronlarını uyarırlar. Buradan kalkan uyarılar da m. spinalis arka boynuzu ve trigeminal sinirin sensoriyal çekirdeğine giderek presinaptik ve postsinaptik bağlantılarla inhibisyon oluşturur. Supraspinal inhibisyondan sorumludurlar.
2. Retiküler formasyonun bazı çekirdeklerinden başlayıp, m. spinalis arka boynuzunda sonlanan noradrenerjik nitelikteki lifler. Bunların temel nörotransmitteri noradrenalindir. Bu yolların başlangıcındaki opioid reseptörlerin aktivasyonu ile supraspinal analjezi elde edilir.
3. Antinosiseptif spinal segmental mekanizmada özellikle spinal yerleşimli enkefalinerjik nöronlar rol oynar. Dinorfin taşıyan bu nöronlar bu bölgede yoğundur.
Tüm bu monoaminerjik ve enkefalinerjik antinosiseptif etkiler; hücresel düzeyde, lamina I ve II’de bulunan nosiseptif projeksiyon nöronları üzerinde K+ iyonu membran iletkenliğini arttırarak ve hiperpolarizasyon oluşturarak ortaya çıkar. Ayrıca genel bir inhibitör madde olarak gama amino butirik asit (GABA)’nın da antinosiseptif mekanizmalara katıldığı düşünülmektedir. Projeksiyon nöronları üzerinde hızlı ve kısa süreli inhibisyon, en çok monoaminerjik transmitterler GABA ve kısmen de enkefalin ile olmaktadır. Daha uzun süreli inhibisyon endorfin, kısmen enkefalin ve somatostatin ile oluşmaktadır. Glisin ve GABA’nın medulla spinaldeki segmental ağrı inhibisyonunda önemli rolleri vardır. Bunlar dışında somatostatin ve bombesin gibi nöropeptidler de inhibitör etki yapar.
Diğer Ağrı Düzenleyen İnici Yolakla
* Korteksten nükleus gracilis ve kuneatusa, retikülar formasyona, talamusa inenler,
* Periaquaduktal gri cevherden kalkan ve direkt olarak dorsal boynuza, medullanın raphe çekirdeğini geçip ve ardından dorsal boynuza geçenler,
* Lokus seruleus’tan kalkan ve spinal kordun dorsal boynuzuna geçenler.
Sonuçta çok karmaşık olan ağrı ve ağrı fizyolojisine güncel bilgiler ışığında yaklaşılmaya çalışıldı. Toplumun çok büyük bir kesimini ilgilendiren ağrı ile baş edebilmek için ağrı mekanizmalarının iyi bilinmesi gerekir. Son yıllarda epeyce yol alınmasına karşın, ağrı ve fizyopatolojisi konusunda yapılan çalışmalar artarak devam etmektedir.
© Buradaki bilgilerin herhangi bölümü veya tamamı Prof. Dr Ersin Erdoğan’ın müsaadesi olmadan kullanılamaz veya çoğaltılamaz.
Bu yazıdaki bilgiler genel bilgi vermek amacı ile hazırlanmış olup bir doktordan alınan bilgilerin yerine kullanılamaz.